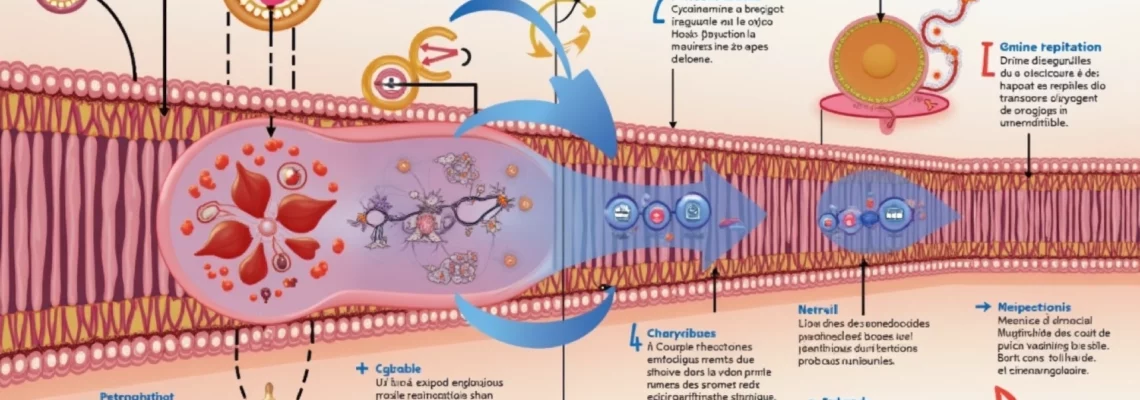
L’oxygène constitue l’un des éléments les plus vitaux pour le fonctionnement optimal de chaque cellule de notre organisme. Cette molécule diatomique, représentant environ 21% de l’air que nous respirons, joue un rôle central dans la production d’énergie cellulaire et le maintien de l’homéostasie. Les mécanismes complexes qui régissent l’oxygénation cellulaire impliquent une cascade de processus physiologiques, depuis la capture de l’oxygène au niveau pulmonaire jusqu’à son utilisation dans les mitochondries pour la synthèse d’ATP. Une compréhension approfondie de ces mécanismes révèle pourquoi une oxygénation optimale s’avère essentielle pour préserver la vitalité cellulaire et prévenir le développement de pathologies liées à l’hypoxie.
Mécanismes de transport et diffusion de l’oxygène au niveau cellulaire
Processus de diffusion passive à travers les membranes plasmiques
La diffusion passive de l’oxygène à travers les membranes cellulaires constitue le mécanisme fondamental permettant l’entrée de cette molécule vitale dans le cytoplasme. Ce processus obéit aux lois physiques de la diffusion, où les molécules d’oxygène migrent naturellement des zones de forte concentration vers les zones de faible concentration. La membrane plasmique, composée d’une bicouche phospholipidique, présente une perméabilité sélective qui favorise le passage de l’oxygène grâce à sa nature lipophile et sa petite taille moléculaire.
L’efficacité de cette diffusion dépend de plusieurs facteurs critiques, notamment la surface d’échange disponible, l’épaisseur de la membrane et la différence de concentration de part et d’autre de celle-ci. Les cellules ont développé diverses adaptations morphologiques pour optimiser ce processus, comme l’augmentation de la surface membranaire par la formation de microvillosités ou d’invaginations. Ces adaptations permettent d’accroître significativement les échanges gazeux, particulièrement dans les tissus à haute demande métabolique.
Rôle des aquaporines et canaux ioniques dans le transport gazeux
Bien que la diffusion passive reste le mécanisme principal, certaines protéines membranaires facilitent le transport de l’oxygène et d’autres gaz. Les aquaporines, initialement découvertes pour leur rôle dans le transport de l’eau, présentent également une capacité à faciliter le passage de petites molécules gazeuses comme l’oxygène et le dioxyde de carbone. Ces canaux protéiques créent des voies préférentielles qui accélèrent les échanges gazeux transmembranaires.
Les canaux ioniques, quant à eux, peuvent indirectement influencer l’oxygénation cellulaire en modifiant le potentiel membranaire et l’équilibre osmotique. Ces modifications affectent la conformation de la membrane et peuvent ainsi moduler sa perméabilité aux gaz. Certains canaux potassiques sont particulièrement sensibles aux variations d’oxygène et participent aux mécanismes de détection de l’hypoxie au niveau cellulaire.
Gradient de concentration et loi de fick appliquée aux échanges respiratoires
La loi de Fick décrit mathématiquement le processus de diffusion et s’applique parfaitement aux échanges gazeux cellulaires. Cette loi stipule que le flux de diffusion d’un gaz est directement proportionnel au gradient de concentration et à la surface d’échange, et inversement proportionnel à l’épaisseur de la barrière de diffusion. Dans le contexte cellulaire, cette relation permet de quantifier précisément les échanges d’oxygène entre le milieu extracellulaire et l’intérieur de la cellule.
Le gradient de concentration d’oxygène entre le sang et les tissus peut varier considérablement selon l’activité métabolique des cellules. Au repos, la pression partielle d’oxygène dans le sang artériel avoisine les 100 mmHg, tandis qu’elle descend à environ 40 mmHg dans le sang veineux. Cette différence de pression crée une force motrice puissante pour la diffusion de l’oxygène vers les cellules qui en ont besoin. Les cellules à haute activité métabolique, comme les neurones ou les cardiomyocytes, maintiennent des gradients de concentration plus importants pour assurer un apport suffisant en oxygène.
Transport par l’hémoglobine et coefficient de saturation en oxygène
L’hémoglobine représente le principal vecteur de transport de l’oxygène dans l’organisme, assurant plus de 98% du transport d’oxygène sanguin. Cette protéine tétramèrique, contenant quatre groupements héminiques avec un atome de fer central, présente une affinité remarquable pour l’oxygène. La courbe de dissociation de l’oxyhémoglobine illustre la relation complexe entre la pression partielle d’oxygène et le coefficient de saturation de l’hémoglobine.
Cette courbe sigmoïdale révèle la coopérativité de la fixation de l’oxygène : la liaison du premier atome d’oxygène facilite la fixation des suivants, créant un mécanisme d’amplification efficace. Plusieurs facteurs modulent cette affinité, notamment le pH sanguin (effet Bohr), la température, la concentration en 2,3-diphosphoglycérate et la pression partielle en dioxyde de carbone. Ces mécanismes de régulation permettent une adaptation fine du transport d’oxygène aux besoins tissulaires variables.
Chaîne respiratoire mitochondriale et production d’ATP cellulaire
Complexes enzymatiques de la phosphorylation oxydative
La chaîne respiratoire mitochondriale constitue le système enzymatique le plus sophistiqué de la cellule pour la production d’énergie. Elle comprend quatre complexes protéiques majeurs enchâssés dans la membrane interne mitochondriale : le complexe I (NADH déshydrogénase), le complexe II (succinate déshydrogénase), le complexe III (cytochrome bc1) et le complexe IV (cytochrome c oxydase). Ces complexes travaillent de manière coordonnée pour transférer les électrons depuis les donneurs d’électrons (NADH et FADH2) jusqu’à l’accepteur final, l’oxygène.
Chaque complexe présente une organisation structurale spécialisée optimisant le transfert d’électrons et le pompage de protons. Le complexe I, par exemple, contient plus de 40 sous-unités protéiques et utilise des centres fer-soufre pour le transport électronique. Cette architecture complexe permet non seulement un transfert efficace des électrons mais aussi la translocation de protons à travers la membrane, créant le gradient électrochimique nécessaire à la synthèse d’ATP. L’efficacité de ces complexes détermine directement la capacité cellulaire à produire de l’énergie en présence d’oxygène.
Cytochrome c oxydase et consommation terminale d’oxygène
Le complexe IV, ou cytochrome c oxydase, représente l’enzyme terminale de la chaîne respiratoire et constitue le site de consommation finale de l’oxygène cellulaire. Cette enzyme remarquable catalyse la réduction de l’oxygène moléculaire en eau, une réaction qui libère une quantité considérable d’énergie. La cytochrome c oxydase contient deux centres actifs avec des atomes de cuivre et de fer qui facilitent cette réduction tétraélectronique complexe.
Cette enzyme présente une régulation sophistiquée qui permet d’ajuster la consommation d’oxygène aux besoins énergétiques cellulaires. Des mécanismes d’inhibition allostérique impliquant l’ATP, l’ADP et les ratios NADH/NAD+ modulent son activité. La cytochrome c oxydase peut également être régulée par des modifications post-traductionnelles, notamment la phosphorylation, qui influence sa cinétique enzymatique. Cette régulation fine assure une utilisation optimale de l’oxygène disponible et prévient la formation excessive d’espèces réactives de l’oxygène.
Couplage chimiosmotique et synthèse d’ATP par l’ATP synthase
Le couplage chimiosmotique, concept révolutionnaire proposé par Peter Mitchell, explique comment l’énergie du gradient de protons est convertie en liaison phosphate à haute énergie dans l’ATP. L’ATP synthase, souvent décrite comme un moteur moléculaire rotatif , utilise la force protonmotrice générée par la chaîne respiratoire pour synthétiser l’ATP à partir d’ADP et de phosphate inorganique. Cette enzyme complexe comprend deux domaines principaux : F0, enchâssé dans la membrane et formant un canal à protons, et F1, qui contient le site catalytique.
Le mécanisme de rotation de l’ATP synthase constitue l’un des exemples les plus élégants de nanomachine biologique. Chaque tour complet de la sous-unité gamma permet la synthèse de trois molécules d’ATP, avec un rendement énergétique remarquable. Ce processus requiert un gradient de protons suffisant, généralement maintenu par le transport d’électrons couplé à l’oxygène. La disruption de ce couplage, par des découplants chimiques ou des dysfonctionnements mitochondriaux, entraîne une dissipation de l’énergie sous forme de chaleur plutôt qu’en ATP utilisable.
Rendement énergétique du cycle de krebs en conditions aérobies
En présence d’oxygène, le métabolisme cellulaire atteint son efficacité maximale grâce à l’oxydation complète des substrats énergétiques dans le cycle de Krebs. Cette voie métabolique, également connue sous le nom de cycle de l’acide citrique, permet l’oxydation complète d’une molécule de glucose en six molécules de CO2, générant ainsi un maximum d’équivalents réducteurs (NADH et FADH2). Ces coenzymes réduites alimentent ensuite la chaîne respiratoire pour produire de l’ATP.
Le rendement énergétique théorique de la respiration aérobie atteint environ 32 molécules d’ATP par molécule de glucose, soit une efficacité d’environ 40% de conversion de l’énergie chimique. Cette efficacité remarquable contraste fortement avec la fermentation anaérobie, qui ne produit que 2 molécules d’ATP par glucose. L’oxygène agit donc comme un multiplicateur énergétique , permettant aux cellules de maximiser l’extraction d’énergie des nutriments disponibles. Cette différence explique pourquoi les tissus à haute demande énergétique sont particulièrement vulnérables à l’hypoxie.
Stress oxydatif et systèmes antioxydants endogènes
Formation des espèces réactives de l’oxygène et radicaux libres
Paradoxalement, l’oxygène indispensable à la vie cellulaire peut également générer des espèces chimiques hautement réactives et potentiellement destructrices. Les espèces réactives de l’oxygène (ERO) se forment principalement lors du métabolisme mitochondrial normal, où environ 1 à 3% de l’oxygène consommé est converti en formes partiellement réduites. Ces ERO incluent l’anion superoxyde (O2•-), le peroxyde d’hydrogène (H2O2) et le radical hydroxyle (•OH), chacun présentant des propriétés chimiques distinctes et des potentiels de dommages variables.
La production d’ERO augmente considérablement dans certaines conditions pathophysiologiques, notamment lors de l’ischémie-reperfusion, l’inflammation chronique ou l’exposition à des xénobiotiques. Les sources cellulaires de production incluent non seulement les mitochondries, mais aussi la NADPH oxydase, la xanthine oxydase et les enzymes du cytochrome P450. Cette production accrue peut dépasser les capacités antioxydantes cellulaires, créant un état de stress oxydatif caractérisé par des dommages aux lipides membranaires, aux protéines et à l’ADN.
Superoxyde dismutase et catalase dans la détoxification cellulaire
La superoxyde dismutase (SOD) constitue la première ligne de défense contre le stress oxydatif en catalysant la dismutation de l’anion superoxyde en peroxyde d’hydrogène et oxygène moléculaire. Trois isoformes de SOD coexistent dans les cellules mammaliennes : la SOD1 cytosolique (Cu/Zn-SOD), la SOD2 mitochondriale (Mn-SOD) et la SOD3 extracellulaire. Chaque isoforme présente une localisation subcellulaire spécifique qui permet une détoxification ciblée des ERO selon leur site de production.
La catalase complète l’action de la SOD en décomposant le peroxyde d’hydrogène en eau et oxygène moléculaire. Cette enzyme héminique, principalement localisée dans les peroxysomes, présente l’une des constantes catalytiques les plus élevées connues, permettant la détoxification rapide de grandes quantités de H2O2. L’efficacité de ce système biphasique SOD-catalase détermine largement la résistance cellulaire au stress oxydatif. Des déficiences génétiques dans ces enzymes sont associées à des pathologies graves, soulignant leur rôle crucial dans la protection cellulaire.
Glutathion peroxydase et système de défense thiol-disulfure
Le système glutathion constitue l’un des mécanismes antioxydants les plus polyvalents et abondants de la cellule. La glutathion peroxydase (GPx) utilise le glutathion réduit (GSH) comme donneur d’électrons pour réduire le peroxyde d’hydrogène et les hydroperoxydes lipidiques en composés moins réactifs. Cette réaction produit du glutathion oxydé (GSSG), qui est ensuite régénéré par la glutathion réductase en utilisant le NADPH comme cofacteur réducteur.
Le rapport GSH/GSSG sert d’indicateur sensible du statut redox cellulaire et influence de nombreux processus physiologiques, notamment la signalisation cellulaire, l’apoptose et l’expression génique. Plusieurs isoformes de GPx présentent des spécificités de substrat et des localisations différentes : GPx1 (cytosolique et mitochondriale), GPx2 (gastro-intestinale),
GPx3 (extracellulaire) et GPx4 (phospholipide hydroperoxyde glutathion peroxydase). Cette dernière joue un rôle particulièrement important dans la protection des membranes cellulaires contre la peroxydation lipidique, un processus destructeur qui peut compromettre l’intégrité structurelle et fonctionnelle des cellules.
Balance redox et régulation de l’homéostasie oxydative
L’homéostasie redox cellulaire résulte d’un équilibre délicat entre la production d’espèces réactives de l’oxygène et leur neutralisation par les systèmes antioxydants. Cette balance redox ne constitue pas simplement un mécanisme de protection, mais agit également comme un système de signalisation sophistiqué régulant de nombreux processus cellulaires. Les variations contrôlées du statut redox influencent l’expression génique, l’activité enzymatique et la communication intercellulaire, permettant aux cellules de s’adapter aux changements environnementaux.
La régulation de cette balance implique des mécanismes transcriptionnels et post-transcriptionnels complexes. Le facteur de transcription Nrf2 (Nuclear factor erythroid 2-related factor 2) joue un rôle central en activant l’expression d’enzymes antioxydantes en réponse au stress oxydatif. Sous conditions normales, Nrf2 est maintenu dans le cytoplasme par sa protéine inhibitrice Keap1. Lors d’un stress oxydatif, cette interaction est perturbée, permettant à Nrf2 de migrer vers le noyau et d’activer la transcription de gènes cytoprotecteurs. Cette réponse adaptative illustre la capacité remarquable des cellules à ajuster leurs défenses selon les conditions oxydatives.
Hypoxie cellulaire et mécanismes adaptatifs compensatoires
L’hypoxie cellulaire déclenche une cascade de réponses adaptatives orchestrées principalement par le facteur inductible par l’hypoxie (HIF-1). Ce système de détection et de réponse à l’hypoxie permet aux cellules de survivre temporairement dans des conditions de faible oxygénation. HIF-1 agit comme un hétérodimère composé de deux sous-unités : HIF-1α, sensible à l’oxygène, and HIF-1β, constitutively expressed. En normoxie, HIF-1α est rapidement dégradée par le protéasome après hydroxylation par les prolyl-hydroxylases, qui nécessitent l’oxygène comme cofacteur.
Lorsque l’oxygène devient limitant, l’activité des prolyl-hydroxylases diminue, permettant l’accumulation de HIF-1α et son transport vers le noyau. Le complexe HIF-1 ainsi formé active la transcription de plus de 100 gènes impliqués dans l’adaptation à l’hypoxie. Ces gènes codent pour des protéines facilitant l’angiogenèse (VEGF), le transport du glucose (GLUT1, GLUT3), la glycolyse anaérobie (aldolase, énolase) et l’érythropoïèse (érythropoïétine). Cette reprogrammation métabolique permet aux cellules de maintenir une production d’ATP réduite mais suffisante pour les fonctions vitales essentielles.
Les mécanismes adaptatifs incluent également des modifications post-traductionnelles rapides qui optimisent l’utilisation de l’oxygène disponible. La phosphofructokinase, enzyme limitante de la glycolyse, voit son activité augmentée, favorisant la production anaérobie d’ATP. Simultanément, certaines voies métaboliques moins essentielles sont réprimées pour économiser l’énergie cellulaire. Ces adaptations, bien qu’efficaces à court terme, ne peuvent compenser indéfiniment une hypoxie prolongée sans compromettre la viabilité cellulaire.
Pathologies liées aux dysfonctionnements de l’oxygénation cellulaire
Les dysfonctionnements de l’oxygénation cellulaire sous-tendent de nombreuses pathologies graves, allant des maladies cardiovasculaires aux troubles neurodégénératifs. L’ischémie myocardique illustre parfaitement les conséquences dramatiques d’une oxygénation insuffisante : la réduction du flux sanguin vers le muscle cardiaque entraîne rapidement une baisse de la production d’ATP, compromettant la fonction contractile et pouvant conduire à la mort cellulaire. Le phénomène d’ischémie-reperfusion, où la restauration du flux sanguin génère paradoxalement des dommages supplémentaires par la production massive d’ERO, souligne la complexité des mécanismes impliqués.
Les pathologies neurodégénératives comme la maladie d’Alzheimer et la maladie de Parkinson présentent également des dysfonctionnements mitochondriaux majeurs affectant l’oxygénation cellulaire. Dans ces conditions, l’accumulation de protéines mal repliées interfère avec la fonction de la chaîne respiratoire, réduisant l’efficacité de la production d’ATP et augmentant la génération d’ERO. Cette spirale dégénérative contribue à la progression de la neurodégénération et explique pourquoi ces pathologies affectent préférentiellement les neurones à haute demande énergétique.
Le cancer représente un exemple particulièrement complexe de dysrégulation de l’oxygénation cellulaire. Les cellules tumorales développent souvent une adaptation métabolique appelée « effet Warburg », caractérisée par une préférence pour la glycolyse anaérobie même en présence d’oxygène suffisant. Cette reprogrammation métabolique, bien que moins efficace énergétiquement, procure des avantages adaptatifs aux cellules cancéreuses, notamment en fournissant des précurseurs métaboliques pour la biosynthèse et en créant un environnement favorable à leur prolifération. L’hypoxie tumorale active également HIF-1, favorisant l’angiogenèse et la résistance aux traitements anticancéreux.
Optimisation thérapeutique de l’oxygénation tissulaire par oxygénothérapie hyperbare
L’oxygénothérapie hyperbare (OHB) représente une approche thérapeutique sophistiquée visant à optimiser l’oxygénation tissulaire dans diverses conditions pathologiques. Cette technique consiste à administrer de l’oxygène pur à une pression supérieure à la pression atmosphérique normale, typiquement entre 2 et 3 atmosphères absolues. Ces conditions permettent d’augmenter significativement la dissolution physique de l’oxygène dans le plasma sanguin, indépendamment de la capacité de transport de l’hémoglobine.
Les mécanismes d’action de l’OHB sont multiples et complexes. L’hyperoxygénation tissulaire stimule l’angiogenèse par l’activation de facteurs de croissance vasculaire, améliore la fonction des leucocytes et favorise la synthèse de collagène. Ces effets se révèlent particulièrement bénéfiques dans le traitement des plaies chroniques, où l’hypoxie tissulaire constitue un facteur limitant majeur de la cicatrisation. L’OHB exerce également des effets antibactériens directs, particulièrement efficaces contre les bactéries anaérobies, et peut potentialiser l’action de certains antibiotiques.
Les indications cliniques de l’oxygénothérapie hyperbare s’étendent des urgences médicales comme l’intoxication au monoxyde de carbone aux pathologies chroniques telles que l’ostéoradionécrose ou le pied diabétique. Dans le domaine oncologique, l’OHB fait l’objet de recherches prometteuses pour sensibiliser les tumeurs hypoxiques à la radiothérapie. Cependant, cette thérapie nécessite une expertise technique spécialisée et présente des contre-indications spécifiques, notamment chez les patients atteints de certaines pathologies pulmonaires ou cardiaques. L’optimisation des protocoles d’OHB continue de faire l’objet d’investigations cliniques pour maximiser ses bénéfices thérapeutiques tout en minimisant les risques potentiels.